- Самодельный аккумулятор для бесперебойника из «хлама»
- Как сделать аккумулятор своими руками
- Ремонт аккумулятора ноутбука своими руками: инструкция
- Как сделать аккумулятор своими руками
- Охлаждение температуры компьютера
- Качественные системы зарядки Li-ion 18650
- Безопасное извлечение
- Самодельная батарейка из подручных средств
- Способ первый: батарейка из лимона
- Способ второй: банка с электролитом
- Способ третий: медные монеты
- Способ четвертый: батарейка в пивной банке
- Способ пятый: батарейка из картошки
- Способ шестой: графитовый стержень
- №2. Медная обмотка.
- №3. Раствор.
- Что потребуется?
- Размеры
- Программирование разума
- Как заменить элементы аккумуляторной батареи ноутбука Toshiba Satellite T230-12T
- Справочник химика 21
- Пару слов о щелочном электролите
- Испытания электромобиля QUANTiNO 2 совместно с bi-ION от nanoFlowcell Holdings
- Отличия современных потоковых батарей от nanoFlowcell
- Принцип работы проточных (потоковых) батарей
- Преимущества потоковых аккумуляторов
- Кислота и свинец
Самодельный аккумулятор для бесперебойника из «хлама»
SLV__ 20 апреля 2015
- Компьютерные самоделки и тюнинг
Сегодня у нас полезная самоделка для компьютера, вернее для его защиты : самодельная аккумуляторная батарея для ИБП собранная из элементов «АА»
Привет всем ! Хочу поделится методом изготовления аккумулятора для бесперебойника из пальчиковых аккумуляторов размера АА.
Идея пришла в голову после того как мой бесперебойник сдох (точнее аккум в нем), а цены на новый аккумулятор (1000 рублей) высоковаты, да и менять батарею каждый год ради двух-трёх срабатываний (толчков по питанию) не хотелось.
У меня есть некоторое количество пальчиковых аккумуляторов, вот из них я сделаю себе новый аккумулятор для бесперебойника.
Так как аккумуляторы мягко говоря не совсем новые, то они проходят у меня «кастинг» на пригодность и тренировку в специальном зарядно-разрядно м устройстве для никель-кадмиевых аккумуляторов.
Для обеспечения нужного «ампеража» я соединил 5 батареек параллельно (получается около 5 А/часов)
Ну, а для обеспечения нужного напряжения в 12 вольт нужно будет 10 таких секций. (Если Вам интересно, посмотрите как правильно подключить светодиод к 12 вольтам по ссылке есть онлайн калькулятор расчета резисторов для светодиодов).
Потом всё это богатство объединяю с такой себе кирпич и соединяю уже последовательно.
Припаиваю клемы (которые выкорчевал из старого аккума) и измеряю напругу.
Далее необходимо изолировать токоведущие части. Я взял кусок старого линолеума и простой (синий ) скотч .
Вот , что получилось в итоге (по-моему ниче-так )
При реальном испытании в бесперебойнике аккум продержал комп с монитором 4 минуты, просев при этом, до 11,2 вольта. (дальше не стал разряжать , но думаю мин 5 там еще было).
В заключении этой короткой статьи скажу, что жду от этого аккумулятора гораздо большего срока службы чем от кислотного .
Жду критики и дельных советов .
Всем удачных поделок и соблюдайте меры безопасности.
Источник
Как сделать аккумулятор своими руками
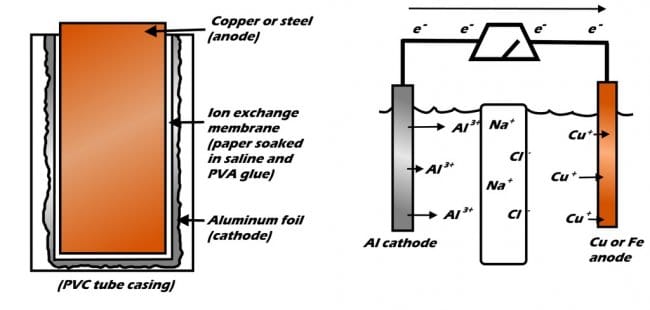
Есть множество способов сделать самодельные батарейки. К сожалению, большинство самодельных аккумуляторов либо бесполезны, либо потенциально опасны и сложны в изготовлении. Батареи из лимона и картофеля, как правило, очень слабые и требуют в качестве материала скоропортящегося органического растительного материала, в конструкцию свинцово-кислотных аккумуляторов входят высокотоксичные и едкие химикаты и т.д.
Эта батарея сделана из очень простых и доступных материалов, и обладает достаточной мощностью для работы устройств. Когда традиционные батареи недоступны эта батарея будет отличным аварийным источником электроэнергии. Кроме того, ее можно легко перезарядить практически от любого источника постоянного тока, она очень легкая и, в отличие от более распространенных алюминиево-воздушных батарей, не требует воздушного потока для работы.
Шаг первый: дизайн и теория
Принцип работы батарей основан на химической реакции, известной как окислительно-восстановительная реакция. В окислительно-восстановительной реакции одно вещество окисляется (теряет электрон), а другое восстанавливается (приобретает электрон). Довольно просто. Любая батарейка устроена схожим образом, в ней обязательны три элемента, между которыми происходит химическая реакция, в результате которой возникает электричество: электроды — анод, катод, и электролит.
В этой алюминиево-металлической батарее две половины батареи пропитаны физиологическим раствором и разделены специальной мембраной, пропускающей только ионы натрия и хлора. Алюминий с одной стороны начинает окисляться, в то же время как медь или сталь на противоположной стороне пытаются остаться стабильными.
В принципе любая батарейка или аккумулятор это две металлические пластины, помещенные в специальное химическое вещество – электролит. Одна пластина подключается к плюсу, вторая к минусу. Пока батарею не трогают, на ней остается стабильное напряжение, например, 3 или 9 В. Стоит подключить к батарейке нагрузку, лампочку, вентилятор, как от плюса к минусу потечет ток. Напряжение начнет падать и сразу же начнется окислительно-восстановительная реакция. Электроны начнут перетекать с отрицательной (-) пластины обратно на положительную, поддерживая тем самым разность потенциалов между ними.
Реакции бывают обратимыми (аккумулятор) и необратимыми (батарейка). Т.е. в батарейке реакция необратимая и ее нельзя зарядить, а в аккумуляторе обратимая и он заряжается. Если подключить аккумулятор к зарядному устройству, ток внутри него начинает течь в обратном направлении, то есть – от «+» к «-». И реакция в электролите также начинает идти в обратном направлении. В результате, продукт реакции разлагается на исходные вещества. Аккумулятор «заряжается»
Конечно, этот процесс не бесконечен и наступит момент, когда одна из пластин разрушится и химическая реакция больше не сможет проходить.

Шаг пятый: зарядка и проверка
Аккумуляторная батарея готова, но ее нужно зарядить. Можно использовать практически любой источник постоянного тока, если ток не слишком велик (до 5 А). Чтобы зарядить аккумулятор, нужно подключите анод к плюсу зарядного устройства, а катод к минусу. Во время зарядки ток начнет уменьшатся по мере того, как батарея набирает заряд. Это является хорошим признаком, и говорит о том, что батарея работает правильно. После зарядки нужно проверить аккумулятор мультиметром. Используя медный анод, мастер получил максимальное напряжение 1,44 В после скромного цикла зарядки. Максимальный ток, который он получил от батареи, был большим для такой самодельной батареи — 1.2 А. Для сравнения, лимонные или картофельные батареи обычно выдают в лучшем случае всего несколько миллиампер. Коммерческая батарея D-cell может выдавать ток более 5А.
Так же мастер провел тест, в котором сравнил свою батарею с настоящим D-элементом на 1,5 В. Обе батареи тестировались с небольшим двигателем постоянного тока. При этом измерялся ток и скорость вращения двигателя. И самодельная и промышленная батареи показали примерно одинаковые результаты.
Конечно, этот аккумулятор не идеален. Ионообменная мембрана по-прежнему пропускает некоторые растворимые соли меди на катодную сторону батареи, где они вступают в реакцию с образованием металлической меди и нерастворимых оксидов и гидроксидов меди. Кроме того, алюминиевый катод постепенно приходит в негодность, по сути, растворяется. Но, несмотря на это, батарея очень удобна и может быть легко собрана и использована людьми в экстремальной ситуации. Увеличивая размер батареи, и подключая несколько ячеек последовательно или параллельно, можно производить или хранить очень большое количество энергии с небольшими затратами.
Источник
Ремонт аккумулятора ноутбука своими руками: инструкция



В 2007 году я купил новый ноутбук Acer с аккумуляторной батареей CGR-B/6H5 емкостью 4400 мАч, будучи абсолютно новым, аккумулятор выдерживал в среднем 2 часа автономной работы, что является нормальным показателем, учитывая емкость аккумулятора и потребляемую мощность ноутбука. И все 4 года ноутбук, как и у многих из вас был постоянно подключен к зарядке т.е. работал всегда от сети. Иногда, мне приходилось использовать ноутбук от батарей и я замечал, что время автономной работы постепенно падает. Таким образом к 2011 году, время работы от встроенной литиевой аккумуляторной батареи составляло 10-15 минут, а спустя несколько месяцев, после того как отключили напряжение – ноутбук вообще перестал включаться от батарей, а процесс зарядки постоянно показывал 0% При этом индикатор и надписи в Windows говорили о том, что процесс зарядки осуществляется. Но чтобы я не делал, все равно ноутбук не хотел работать ни секунды от своих батарей и тут, мне не осталось ничего, кроме того, чтобы разобрать аккумулятор
Как сделать аккумулятор своими руками
Химический источник тока (двухполюсник), способный после разряда восстанавливаться, можно выполнить своими руками. Любой химический источник тока, имеющий периодический режим работы (разряд – заряд), состоит из следующих основных элементов:
- электроды: анод и катод;
- электролит;
- разделительные пластины (сепараторы);
- корпус;
- контактные клеммы (выводы).
В качестве анода и катода используются различные пары химических элементов. Анод имеет отрицательный заряд – восстановитель, катод положительный заряд – окислитель.
Оба электрода погружены в электролит. Это водные растворы солей и кислот, проводящие электричество. Когда происходит разряд аккумулятора (двухполюсника) на нагрузку, анод окисляется и вырабатывает электроны, которые через электролит движутся к катоду. На катоде происходит процесс восстановления окислителя.
Важно! При работе на нагрузку ток через двухполюсник течёт от минуса к плюсу, при зарядке от постороннего источника тока (ИТ) – от плюса к минусу.
Для создания одной банки простейшего аккумулятора из меди и цинка понадобятся следующие детали:
- медная проволока длиной 100 мм;
- оцинкованная пластина размерами 25 * 50 мм;
- прокладка – вырезанная из москитной полиэтиленовой сетки полоска;
- электролит – соляной раствор;
- корпус из непрозрачного материала – герметичный стаканчик из-под кофе с крышкой.
Необходимо, чтобы ёмкость для аккумулятора была непрозрачной.
Сборка элемента производится в следующей последовательности:
- медная проволока скручивается спиралью, для увеличения площади рабочей поверхности к верхнему концу припаивается отвод;
- оцинкованная пластина также скручивается по окружности, к верхней части пластины припаивается отвод;
- в крышке баночки делается два отверстия для выводов: в центре – для медной проволоки и ближе к краю – для вывода цинкового электрода;
- медную спираль располагают по центру, вокруг неё размещают цинковую трубку, между ними вставляют изолирующую прокладку;
- заливают электролит: солёную воду (1л воды на 5 ст. л. соли) или уксус 15%;
- неплотно прикрывают крышку, предварительно продев в неё выводы.
К полученной банке подключают источник тока для зарядки самодельного аккумулятора. При этом нельзя плотно закрывать крышку. Или для выхода газов при заряде в ней проделывается множество мелких отверстий (кроме отверстий для выводов). У самодельного элемента плюс – на медном электроде, минус – на цинковом.
Внимание! Чем меньше расстояние между элементами меди и цинка, и чем больше площадь поверхности электродов, тем большее напряжение выдаст подобная аккумуляторная ячейка.
В идеале такой элемент вырабатывает 0,7 вольта. Недостаток такой АКБ заключается в высоком внутреннем сопротивлении и быстром саморазряде.










Охлаждение температуры компьютера
Если батарея ноутбука стала быстро разряжаться, можно попробовать дополнительно охладить компьютер.
Многие батареи для ноутбуков сегодня оснащены литиево-ионными элементами, которые должны оставаться прохладными, тогда батарея будет работать дольше. Если эта деталь показывает явные признаки замедления, потому что она стала слишком горячей, нужно немедленно отключить компьютер и охладить его.
Когда горячий режим работы — обыденное явление для ПК, то нужно приобрести охлаждающую подставку для компьютера. Она стоит в 5 раз меньше, чем новый аккумулятор, и не позволит ноутбуку быстро потерять элемент автономного питания.










Качественные системы зарядки Li-ion 18650
Как заряжать литий ионный аккумулятор
Литий-ионные источники электричества этого типа широко эксплуатируются с различными устройствами. Для их продолжительной работы необходима постоянная подзарядка. При заряде напряжение на элементе достигает значения 4,2 В, после чего снижается до 2-3 В. При глубоких разрядах (ниже 3 В) срок службы Li-ion 18650 значительно сокращается.

Система для зарядки Li-ion 18650
Важно! На долговечность влияет количество циклов «заряд-разряд». Это оптимальное число циклов, при которых ёмкость батареи при первом заряде (номинальная), отличается от текущей ёмкости после заряда не более, чем на 20%. Нормальным считается показатель – 350-500 циклов «заряд-разряд».
Существуют специальные зарядные устройства для подобных аккумуляторов, но их можно сделать самостоятельно, используя схему.

Схема самодельной зарядки для Li-ion 18650
Регулировка тока осуществляется подбором резистора R4 на первоначальное значение тока зарядки. Он зависит от емкости аккумулятора. Например, если ёмкость батареи 3000 мА/ч, то ток зарядки равен 2-3 А.
Заводские системы контроля заряда самостоятельно делают регулировку этого параметра в рамках всего времени заряда.
Безопасное извлечение
Перед разборкой необходимо убедиться, что аккумулятор ноутбука полностью разряжен. Как только заряд полностью истощится, необходимо дважды проверить ноутбук, прежде чем снимать аккумулятор. Это важно!
Порядок ремонта аккумулятора ноутбука Asus своими руками:
- Открыть корпус аккумулятора. Для этого осторожно распакуйте его с помощью плоской отвертки и универсального ножа. После того как корпус батареи открыт, можно проанализировать тип необходимых батарей и узучить схему соединения для их установки. Перед разборкой лучше сделать снимок или нарисовать схему соединения элементов, чтобы не забыть перед восстановлением. Важно также при открытии принять все меры для предотвращения деформирования или поломки пластикового корпуса батареи.
- Замена ячеек. Используйте вольтметр, чтобы убедиться, что старые ячейки полностью разряжены, прежде чем снимать их. Тем самым вы предотвратите возможный электрический удар.
- Чтобы найти подходящие ячейки для замены, нужно использовать номер модели на аккумуляторной батарее.
- Припаять новые ячейки к проводам, следя за тем, чтобы они подключались к соответствующим проводам.
- При замене литий-ионных элементов используются защитные очки. С ними обращаются осторожно, поскольку они способны взрываться.
- Как только корпус аккумулятора будет закрыт и установлен обратно в ноутбук, его необходимо полностью зарядить.
Самодельная батарейка из подручных средств
Как сделать диммер для паяльника
Как можно сделать аккумуляторы, используя электролит и электроды, рассмотрено выше. Теперь о том, как быстро собрать источник тока однократного действия. Батарейка – это гальванический источник электричества, который не имеет способности восстанавливаться.
Способ первый: батарейка из лимона
Мякоть лимона содержит лимонную кислоту, она послужит электролитом. В качестве электрода выступают оцинкованный гвоздик и отрезок медной проволоки. Они втыкаются в лимон на расстоянии 50-100 мм друг от друга. Реакция окисления запускает движение электрического тока.

Батарейка из лимона
Способ второй: банка с электролитом
Литровую стеклянную банку используют в качестве ёмкости. В качестве электродов берутся цинковая и медная пластины. К пластинам прикрепляются провода, сами они опускаются в банку с электролитом. Им служит 20% раствор серной кислоты. Также можно использовать хлористый аммоний (нашатырь). На 100 мл воды берут 50 г. порошка. Уровень электролита не достигает края банки на 15-20 мм.

Ёмкость с электролитом
Осторожно! Работа с серной кислотой при приготовлении электролита подразумевает добавление воды в кислоту, а не наоборот. При приготовлении раствора необходимо использовать стеклянную посуду и стеклянную или деревянную палочку для перемешивания.
Способ третий: медные монеты
Принцип использования медного катода и алюминиевого анода рассмотрен в этом способе. Процесс изготовления источника тока следующий:
- по форме медных монет одного размера (медный пятак) вырезают кружочки из алюминиевой фольги и плотного картона (обложка старой книги);
- монеты очищаются путём погружения в уксус, им же пропитываются и кружочки картона;
- картон вставляется между монетой и кружком фольги, которые служат катодом и анодом.
Собранная таким образом батарея будет работать до тех пор, пока не высохнет электролит, пропитавший картонные кружки.

Батарейка из монет и алюминиевой фольги
Способ четвертый: батарейка в пивной банке
Сам корпус пивной банки (алюминиевый) служит анодом (минус), в качестве катода используют графит. При изготовлении выполняются следующие шаги:
- удаляется верхняя часть банки;
- пенопластовый кружок диаметром, равным внутреннему диаметру банки, и толщиной не менее 10 мм укладывается на дно банки;
- в его центр вставляется графитовый стержень подходящего диаметра;
- свободное пространство между ним и стенками банки заполняется угольной крошкой;
- соляным раствором (5 ст. л. соли на 0,5 л воды) заполняется полученный элемент;
- верхняя часть устройства заливается расплавленным парафином или стеарином (от свечи);
- к стержню и корпусу банки с помощью зажимов «крокодил» присоединяются провода.

Батарейка в пивной банке
Способ пятый: батарейка из картошки
Это вариант использования химической реакции окисления между медными и оцинкованными полосками, в качестве электролита используется мякоть картофеля.
Внимание! Полученные напряжения таких источников настолько малы, что подобные конструкции могут служить лишь в качестве опытов для изучения происхождения электричества.

Батарейка из картошки
Способ шестой: графитовый стержень
Графитовый сердечник обматывается пористой фибровой салфеткой. Поверх него наматывается по спирали алюминиевая проволока. Вся конструкция опускается в подходящий по размеру стакан, заполненный «Белизной». Водный раствор хлорки служит электролитом.

Графитовый стержень как электрод батарейки
Несмотря на всё разнообразие способов и видов самодельных источников тока, все они работают, благодаря электролитическим процессам и химическим реакциям окисления. Правильно подобранные пары элементов для анода и катода, а также использование подходящего электролитического раствора дают реальные результаты. Можно сделать аккумулятор своими руками для питания гаджетов и малогабаритных устройств.
№2. Медная обмотка.
Теперь наматываем медный провод на ложку в несколько слоев. Но можно и в один. Концы проводов оставляем длинными, так как они будут полюсами. Витки не должны быть намотаны вплотную друг к другу. Оставляем между ними небольшие отступы. После этого возвращаемся к первому шагу и наматываем пленку. Ее нужно наматывать свободно, что оставить доступ раствора к меди. Далее снова наматываем провод. Все это повторяем до 7 раз и больше. На выходе получим довольно толстую катушку с торчащими медными ответвлениями.
№3. Раствор.
В стеклянную емкость насыпаем чайную ложечку соли. Затем добавляем столько же уксуса. Выполняем легкое помешивание. Далее заливаем глицерин из 4-х пузырьков.
Что потребуется?
- Новые аккумуляторные элементы;
- Паяльник, припой, флюс;
- Различный мелкий инструмент: нож, скальпель, дрель;
- Провод 0,7−1 мм;
- Термоскотч.
Что касается, аккумуляторных элементов, то установлены у меня в батарее были LGDAS31865. Каждый элемент имел номинальную ёмкость 2200 мАч. Всего их было 6 штук, спаянных по две штуки в три банки. Изначально ёмкость аккумулятора ноутбука была 4400 мАч. К моменту замены она сократилась почти до 2000 мАч (по показаниям утилиты powercfg.exe в Windows).
Старый 18650 LGDAS31865
Новый 18650 LGABD11865
Для перепаковки аккумулятора выбрал аккумуляторные элементы LGABD11865. Номинал у них 3000 мАч, а максимально допустимый ток разряда составляет 3 ампер. Для ноутбука вполне достаточно.
Размеры

0
Источник:
Обязательно следует учитывать габариты аккумуляторов. Наиболее распространенный типоразмер, который применяется в съемных аккумуляторах ноутбуков, – это цилиндрические 18650, где первыми двумя цифрами обозначается диаметр аккумулятора (18 мм), а 65 мм – его длина. Если длина из-за особенностей конструкции электродов и пр. будет больше, то такие аккумуляторы могут просто не поместиться в старый корпус.
Программирование разума
Как же ре программировать мой мозг. Что это значит. Это же не компьютер.
Как это перепрограммировать. Изменить что то, шестерёнки поменять.
Все это нет так. На самом деле мы подразумеваем автоматические реакции и мысли, которые в нашем разуме отложились для определенных ситуаций. Нужно поменять чтобы получить другой результат, лучший результат.
Чтобы перепрограммировать нужно сначала запрограммировать первый раз ваш разум. Но это не бывает. Никто вас не программирует. Никто вас не программирует. Вокруг разные ситуации, обстоятельства, которые влияют на ваше мышление.
Автоматические мысли поведение ответственны за наше мышление, они поднимаются из нашей психики автоматически и проявляются в нашем поведении, действии, общении. Никто на вас напрямую не влияет не колдует над вами, может над кем-то, но не в массе. Нужно научиться управлять вашим мышлением потому что постоянно негативные мысли доминируют, они автоматически появляются в качестве реакций на все что происходит вокруг.
У вас портится настроение, но можно контролировать свое внимание, на что мы обращаем внимание больше всего, о чем мы начинаем говорить и чувствовать в первую очередь.
Нужно учится мастерству направления разума в продуктивное русло, в эффективный режим. Давайте посмотрим, как это делать.
Уже много раз говорили на других уроках как управлять и мастерски владеть вашей психологией. Как обрести простой рамочный контроль, и понять методы и рычаги воздействия на собственный разум, мышление.
Как заменить элементы аккумуляторной батареи ноутбука Toshiba Satellite T230-12T

0
Источник:
Ноутбук Toshiba эксплуатировался очень интенсивно и практически все время был подключен к сети. Через 5 лет время его автономной работы сократилось примерно на 30%, к тому же аккумулятор стал перегреваться, так что во время зарядки ноутбук стало некомфортно держать на коленях. Если же зарядку не отключали, когда аккумулятор достигал полного заряда, то ноутбук перегревался и отключался сам.
Справочник химика 21
При приготовлении и хранении электролита его предохраняют от доступа воздуха, чтобы предотвратить поглощение углекислоты, так как она увеличивает и снижает емкость. При содержании в электролите до 50 г/л соды или поташа электролит заливать не рекомендуется.
Все остальные неисправности, возникшие при эксплуатации (, , механические повреждения и т.
п.), устраняют обычным способом. Для стабилизации подвергают двум-трем тренировочным циклам нормальных режимов. В отдельных случаях, когда батарея на третьем разряде отдает менее 80% номинальной емкости, следует провести дополнительно 1—2 цикла. В первые два цикла батарею заряжают током 150 А в течение Кроме того, может быть приготовлен электрохимическим способом.
готовится путем в или конденсате.
При приготовлении из вначале получается осадок 5п (ОН)2, который Элемент собран в пластмассовом корпусе. Нижняя часть корпуса , представляющей собой амальгамированный , смешанный с загустителем.
Последний содержит и крахмал. Над расположена пастовая диафрагма, состоящая из щелочного электролита, загущенного крахмалом и . При изменении такая паста не должна ни высыхать, ни намокать.
При намокании пасты раствор будет проникать в поры , снижая его работоспособность.
Электролит, используемый для , представляет собой , насыщенный окисью цинка и содержащий небольшое количество хромовых солей. Для приготовления щелочного электролита следует налить в сосуд дистиллированную воду и доливать щелочь небольшими порциями, тщательно перемешивая электролит железной или .
Пару слов о щелочном электролите
Щелочной электролит – одна из основных составляющих одноименных аккумуляторных батарей. На сегодняшний день подобная субстанция используется во многих АКБ, поэтому актуальность её рассмотрения довольно-таки высока. Типовой состав электролита для щелочных аккумуляторов состоит:
- либо из едкого калия и литиевых соединений;
- либо из едкого натрия и едкого калия, а также того же лития.
Любое из отмеченных выше соединений в определенной концентрации разбавляется с дистиллированной водой, что и формирует раствор-электролит для щёлочи. По формации он жидкий и представляется, на первый взгляд, обычной водой.
На данный момент в сфере аккумуляторных батарей существуют два типовых, борющихся между собой видов электролитов, а именно:
- рассматриваемые нами – щелочные;
- и кислотные.
Первые по сравнению со вторыми более надёжные и долговечные составляющие АКБ. Помимо этого, щелочные электролиты превосходят кислотные во многих параметрах, за исключением одного НО — они не способны выдавать стартовый ток. Этот момент всерьёз подорвал использование «щелочи» в АКБ для автомобилей, поэтому на современных машинах намного чаще встречаются именно кислотные электролиты и соответствующие аккумуляторы.
Испытания электромобиля QUANTiNO 2 совместно с bi-ION от nanoFlowcell Holdings
Проведены совместные испытания работы аккумуляторов на основе bi-ION компаний по производству элетромобилей QUANTiNO 2 и nanoFlowcell Holdings. Батареи продемонстрировали высокую динамику и стабильность работы системы привода даже без суперконденсаторов. За счет этой технологии компании добились увеличения скорости и огромного снижения как веса, так и стоимости нового электромобиля.
Это означает, что относительно скоро мы увидим, как его уже называют, “квантовый электрокар nanoFlowcell” на дорогах. Также ожидается, что такие автомобили будут стоить меньше, чем современные машины с двигателями внутреннего сгорания. Последние тесты этого ё-мобиля уже направлены на подтверждение готовности к серийному производству.
В ходе испытаний, прошедших на автодроме в швейцарском Цюрихе, Quantino преодолел немыслимое расстояние для всех представленных на рынке электромобилей в 1 000 км всего за 8 часов и 21 минуту, при средней скорости в 120 км/ч. А после теста главного инженера NanoFlowcell Нунцио Ла Веккья, проехавшего 1 036 км со средней скоростью в 74 км/ч, имитируя городской цикл движения с незначительными остановками, остаток емкости батареи составила 78%.
В комплектацию двухдверного концепткара nanoFlowcell Quantino входят 4 электрических двигателя с мощностью по 108 л.с. каждый и крутящим моментом в 200 Нм. Автомобиль набирает скорость в 100 км/ч всего за 5 секунд. Машина способна развивать скорость в 100 км/ч за 5 секунд, а процесс зарядки автомобиля на квантовой энергии занимает всего 4 секунды.
Мощный и экологически чистый квантовый двигатель и простой процесс заправки безопасными энергоносителями – основные конкурентные преимущества концепткара nanoFlowcell Quantino.
Электромобиль в действии, а также его внешний вид можно оценить при помощи данного видео
Отличия современных потоковых батарей от nanoFlowcell
Швейцарская компания nanoFlowcell использует более простую и современную конструкцию проточных АКБ. Главное отличие — отсутствие мембраны. Такая технология позволяет использовать лишь один поток, а дорогостоящая и требующая постоянного обслуживания мембрана не используется.
В момент разрядки полисульфаты лития поглощают его ионы, а в момент зарядки ионы возвращаются обратно в жидкость. При этом органический растворитель, через который проходят оба вещества, позволяет не допустить коррозию. Отказ от мембраны и переход на химическую реакцию позволяет современным разработчикам свободно экспериментировать с жидкостями.
В коротком рекламном ролике компания в наглядной форме продемонстрировала все преимущества своей технологии:
Принцип работы проточных (потоковых) батарей
Наиболее известными сегодня ванадиевые проточными аккумуляторами являются Редокс (redox — производное от английского reduction-oxidation, что в переводе означает восстановление-окисление). Принцип работы таких батарей основывается на взаимодействии двух «заряженных» жидкостей-электродов — они выполняют роли плюсового и минусового зарядов. За счет давления, создаваемого насосами, они пропускаются через специальную ячейку. В ней, в результате химического взаимодействия, и производится электрический ток.
Электролиты располагаются в баках, каждый в своем, в ячейке из разделяет мембрана. Она не мешает электродам обмениваться ионной энергией, но и не допускает перемешивание топливной жидкости. Продукты реакции выводятся из ячейки при помощи жидкости, которая затем опять поступает в емкость по замкнутому контуру. Играя роль плюсовых и минусовых полюсов, эти электролиты и получили свое название «жидкие электроды». Отсюда и название АКБ — проточные или потоковые.
Это интересно! Потоковые аккумуляторы изобретены в противовес остальным видам накопителей — это своеобразная и довольно удачная попытка решить проблемы прочих видов аккумуляторов.
Преимущества потоковых аккумуляторов
Потоковые батареи хороши тем, что вещества, которые хранят энергию, изолированы от устройства, в котором происходит выработка тока. Поэтому неважно, сколько именно в аккумуляторе имеется проводящих веществ. В любом случае узел-генератор тока будет только один. Важно, что это очень серьезно снижает и вес, и стоимость таких аккумуляторов.
Важно понимать, что перезаряд подобного производителя-накопителя может происходить не только подачей к нему тока, но и элементарной заменой электропроводящего вещества на такой же новый. И тогда перезарядка происходит всего за пару-тройку минут.
На заметку: такие проточные аккумуляторы способны хранить огромное количество энергии. Чтобы это обеспечить, нужно просто увеличить емкость баков с хранящимися в них электролитом, до необходимой величины.
Кислота и свинец
Наиболее проста в устройстве свинцово-кислотная конструкция для накопления электроэнергии. Для её сборки требуются:
- устойчивая ёмкость, с возможностью её плотного закрытия крышкой;
- электролит – раствор аккумуляторной кислоты и дистиллированной воды;
- свинцовая пластина – можно использовать сплющенный кусок свинца с кабельной изоляции или приобретённый в охотничьем или рыболовном магазине;
- два металлических штыря – электроды, которые необходимо вбить вертикально в свинцовые пластины.
Далее приведем сам процесс изготовления этого устройства. Пластины свинца одеваются на металлические штыри, с небольшим расстоянием между ними. После чего конструкцию погружают в ёмкость с залитым электролитом. Свинец должен полностью находиться под раствором. Контактные концы штырей проводят через крышку ёмкости и надёжно фиксируют на ней. К концам электродов можно подключить потребитель электроэнергии. Ёмкость устанавливают на устойчивой поверхности, после чего заряжают устройство. Усложнив конструкцию, свернув свинцовые пластины в рулон и, соответственно, увеличив их площадь, при малом объёме можно добиться неплохих показателей такого устройства. По этому же принципу делают рулоны в современных гелевых накопителях энергии.

Пластины, подготовленные к погружению в банку
Важно! При работе с самодельными электронакопителями соблюдайте правила безопасности: кислота, использованная в электролите, – довольно агрессивное вещество.
Источник
 SLV__ 20 апреля 2015
SLV__ 20 апреля 2015