Батарея анодная своими руками
Самодельная анодная аккумуляторная батарея
Инженер 3. Гинзбург
Аккумулятор состоит из свинцовых пластин—решеток, в которые впрессована особая замазка так наз. активная масса: пластины помещаются в сосуд с серной кислотой. Отдельный аккумулятор дает напряжение в 2 вольта; а для получения напряжения в 80 вольт, необходимых для питания анодных цепей, соединяют последовательно 40 шт. аккумуляторов.
Отливка пластины производится при помощи деревянной формы, которую нетрудно изготовить каждому любителю.
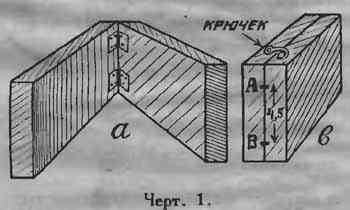
Из сухого дерева отстругивается доска размером 7,5х30 см., толщиной в 2—2,5 см. Доска распиливается под угольник пополам. Обе половинки соединяются петлями таким образом, чтобы они могли складываться и образовывать «книжечку» (черт. 1а).
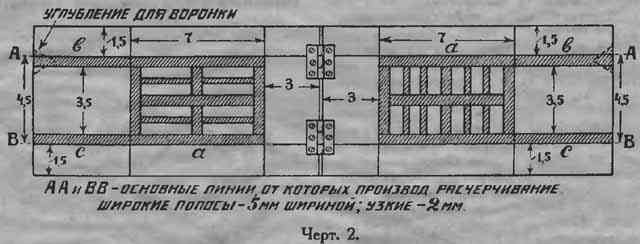
Сложив форму, как показано на рис. 1в, делают карандашем две отметки А и В на расстоянии 4,5 см. друг от друга и 1,5 см. от каждого края. Затем форму раскрывают и расчерчивают ее по черт. 2. Часть а является остовом пластинки с решеткой; в литником для входа металла; с для выхода воздуха при отливке. Расчерчивание нужно делать тщательно и точно, т.к. иначе отдельные половины при отливке могут не совпасть.
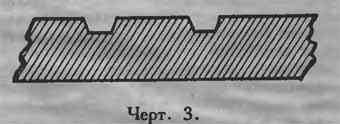
Все, что заштриховано (на черт. 2), вырезается на глубину в 2 мм. Острым ножом проводят по черте, наклоняя острие к середине затушеванной полоски, и делают надрез с обеих сторон. Потом маленькой стамеской или тем же ножом выбирают середину. Должен получиться желобок с отлогими краями (черт. 3), т. к. в противном случае отлитая пластинка будет застревать при вынимании и портить форму. Подобным образом вырезают всю форму, причем сначала надо вырезать все полоски, параллельные волокнам дерева, а затем уже полоски перпендикулярные.
В верхней части литника в вырезают углубление, как показано пунктиром на черт. 2, чтобы при сложенной форме получилась воронка для вливания в форму расплавленного свинца. К бокам формы привертываются крючки.
Перед отливкой каждой пластины форму нужно натирать мелом, т.к. иначе после отливки 2—3 пластин она обгорит и начнет крошиться. В такой форме можно отлить 80—100 шт., если после каждых 5—6 пластин давать ей остынуть. Для большей быстроты отливки можно заготовить несколько таких форм.
Отливку производят следующим образом. В железном ковшичке на паяльной лампе или примусе расплавляют небольшими порциями свинец и медленно льют в форму через литник в до тех пор, пока свинец не покажется из отверстия с. Через минуту форму раскрывают и вынимают из нее готовую пластину. Для следующей отливки форму натирают мелом и закрывают помощью крючков.
Таким образом отливают 80 пластин, 110 одной паре на каждую аккумуляторную банку.
Пластины зачищают, удаляют с них заусенцы и лишний свинец, и отрезают получившийся стержень с.
Заполнение активной массой пластин производится для увеличения емкости аккумулятора.
Активная масса приготовляется отдельно для положительных и отдельно для отрицательных пластин.
Для положительных — берут 10 частей свинцового сурика и 1 часть свинцового глета и, прибавляя понемногу серную кислоту, растирают всю массу до густоты замазки.
Для отрицательных — берут 15 частей глету и 1 часть свинцового сурика и поступают так же, как с массой для положительных пластин.
Для нашей батареи нужно 40 пластин положительных и 40 — отрицательных.
Пластину кладут на стекло и столовым ножем с силой вдавливают замазку в решетку ее. Заполнение производится с обеих сторон, и с таким расчетом, чтобы замазка чуть выступала над поверхностью пластины (на 0,5—1 мм), как с одной, так и с другой стороны.
После этого пластины прессуются, для чего их можно собрать стопочкой, проложив между ними по стеклянной пластинке; сверху кладется кирпич, утюг и пр. В таком положении они должны лежать 2—3 часа. Затем пресс разбирается и пластины хорошо просушиваются.
Сборка аккумулятора. Для сборки лучше всего взять плоские стеклянные банки 5х3 см., высотой в 10 см. Такие банки можно достать в электротехнических магазинах. Цена их — около 10 коп. за шт. Нужно их 40 шт.
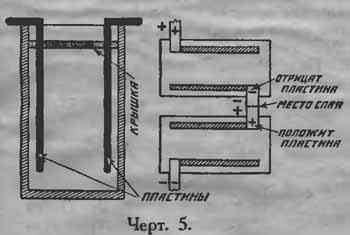
В каждую банку помещают две пластины: положительную (красную) и отрицательную (серую). Соединительные концы пластин загибают под прямым углом таким образом, чтобы, когда пластина помещена в банке, нижний край ее отстоял от дна на 1 см. (см. черт. 5).
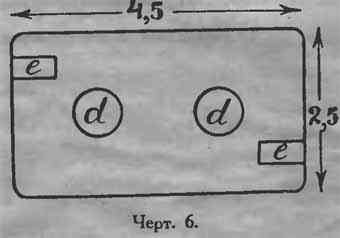
Концы продеваются через отверстия е крышки (черт. 6), сделанной из проваренного в парафине картона. Чтобы нижние концы пластин не соприкасались между собой, в каждую банку помещают между ними (пластинами) кусок стеклянной трубки, длиной 6—7 см.
Крышку вдвигают в банку на 0,5—0,75 см. ниже верхнего края. В отверстия крышки d вставляют кусочки стеклянной трубки, и заливают крышку до верху банки парафином или чаттертоном. Трубки из отверстий d вынимают и заменяют резиновыми пробками. При отсутствии последних можно взять обыкновенные пробки, предварительно проварив их в парафине.
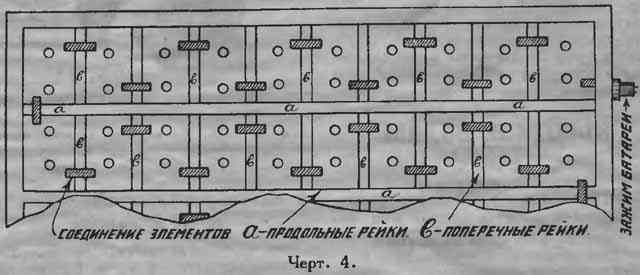
Когда все банки собраны, как указано выше, их помещают в деревянный ящик в 4 ряда (см. черт. 4). Ящик должен быть пропарафинен, т.к. в противном случае пары кислоты раз’едают дерево и приводят его скоро в негодное состояние. Между банками прокладываются деревянные рейки, сечением 4х1 см. Продольные рейки имеют длину 39 см., поперечные 23 см.
Размеры ящика (внутренние): длина 39 см., ширина 23 см. и высота 12 см.
Банки располагаются таким образом, чтобы положительная пластина одной была против отрицательной пластины другой, и соединительные концы их спаиваются. Начало и конец батареи выводится к клеммам на стенке ящика.
Плюсом батареи будет конец от положительной (красной) пластины.
Банки должны сидеть в ящике плотно и не шататься; в противном случае при переноске они могут разбиться.
Сверху ящик закрывают крышкой, которую укрепляют на петлях.
Банки заливают серной кислотой в 23° Бомэ, на 1 см. выше верхнего края пластины. Чтобы не возиться самому с разбавлением кислоты, лучше всего ее приобретать уже разведенной до надлежащей крепости.
Собранную аккумуляторную батарею нужно 2 раза зарядить и разрядить. После этого она готова к действию. Заряжают током в 0,1 ампера.
Емкость такого аккумулятора будет от 1,2 до 1,4 ампер-часа.
Источник
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ: САМОДЕЛЬНАЯ БАТАРЕЯ
Каждому из нас знакомы химические источники тока различных типов и форм. Но как это часто случается, мы редко задумываемся о том, как устроен этот совершенно привычный и обыденный предмет. А между тем, появление первых химических источников тока, положило начало превращению электричества из лабораторной диковинки в нашего повседневного помощника.
В 1790 г. итальянский физиолог Луиджи Гальвани заметил, что лапка препарированной лягушки дергается, если к ней одновременно прикоснуться двумя инструментами из разных металлов. В то время уже было известно, что мышцы могут сокращаться под действием электрического тока, так, что Гальвани правильно приписал это явление действию электрического тока. Правда, он считал, что электрический ток появляется благодаря каким-то физиологическим процессам в лапке лягушки.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока [1]. Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток [2].
Электрическое напряжение, возникающее между электродами, зависит от того, из каких металлов изготовлены электроды и от их взаимодействия с электролитом. Напряжение, даваемое элементом, никак не зависит от площади пластин.
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов [3]. Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
По той же самой причине скручивать вместе медные и алюминиевые провода, это, мягко говоря, не самая лучшая идея. В месте контакта начнется гальваническая коррозия, которая приведет к росту электрического сопротивления контакта, что в свою очередь приведет к большему выделению тепла и еще более быстрой коррозии. Все вместе это может стать причиной разрушения соединения и даже пожара.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления [2]. Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода [2]. Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Изготовление батарейки
При изготовлении демонстрационной батареи гальванических элементов будем использовать стандартную пару – медь и цинк. Медную фольгу можно найти в некоторых трансформаторах. В крайнем случае, можно сделать медный электрод из свернутой в спираль голой медной проволоки [4]. Цинк можно добыть из разрядившихся солевых элементов питания, как правило, в них остается достаточно много металлического цинка даже, когда элемент непригоден к дальнейшему использованию. Вместо раствора кислоты, возьмем 10% раствор поваренной соли. В качестве емкости для электролита взяты пластиковые емкости от витаминов объемом примерно 50-100 мл.
В качестве контактов использованы винты, которые одновременно закрепляю электроды на крышке. При этом крайне желательно крепить медные электроды латунным винтом. Цинковую пластину можно без проблем крепить стальным винтом. Для герметизации под гайку подложена подходящая по размеру резиновая сантехническая прокладка.
Батарея из трех гальванических элементов позволяет питать светодиод.
Напряжение на одном элементе батареи составляет около 1 В.
Ток, отдаваемый в нагрузку, составляет около 0,23 мА
Такого тока достаточно для свечения светодиода. Однако на фотографии это свечение можно заметить, только если снимать при большой светочувствительности.
Такую батарею можно использовать в школе, например для выполнения лабораторной работы, по определению внутреннего сопротивления источника тока [5].
Источник