- Батарейка своими руками — способы изготовления
- Устройство и принцип работы батареи
- Как сделать батарейку своими руками
- Лимон
- Банка с электролитом
- Медные монеты
- Пивная банка
- Картошка, соль и зубная паста
- Как сделать аккумулятор своими руками
- Как сделать аккумулятор
- Как сделать аккумулятор своими руками
- Как сделать мощный аккумулятор своими руками
- Качественные системы зарядки Li-ion 18650
- Самодельная батарейка из подручных средств
- Способ первый: батарейка из лимона
- Способ второй: банка с электролитом
- Способ третий: медные монеты
- Способ четвертый: батарейка в пивной банке
- Способ пятый: батарейка из картошки
- Способ шестой: графитовый стержень
- Видео
Батарейка своими руками — способы изготовления
В эпоху электроприборов не удивительно, что нас окружает электричество. Тем не менее не все знают, что для получения напряжения нужны специальные устройства. Достаточно будет и обыденных вещей, включая продукты питания, которые есть у каждого дома. Правда уровень напряжения и емкости будет далек от привычных источников питания, и в реальных условиях подобную батарейку не используешь, но в качестве эксперимента попробовать можно. Ниже инструкция, как делается самодельная батарейка из подручных материалов.

Устройство и принцип работы батареи
Рассмотрим «на пальцах», как устроен элемент питания. Допустим, есть емкость с кислотой, куда погружен цинковый и медный электроды. Когда элемент даст ток по внешней цепи, цинк на поверхности электрода растворится. Растворенные в электролите атомы цинка – заряженные током ионы, которые оставляют в металле пару электронов, заряженных на «минус». Название этой реакции – окисление.
Пока цинк взаимодействует с электролитом, два иона водорода с положительным зарядом из рабочей жидкости «соединяются» с двумя электронами не «теле» электрода из меди, образуя тем самым молекулу водорода. Название реакции – восстановление.
Электроды из меди и цинка соединены внешним проводом – по нему передаются электроны. Водород, точнее его молекулы, появляющиеся на меди в ходе восстановления, преобразуются в газообразный водород.
Теперь об электролите. Уровень его кислотности напрямую влияет на напряжение в гальваническом элементе. Меньше кислотность – падает напряжение. В рабочих жидкостях с повышенной кислотностью электрод из цинка просто растворится, даже когда цепь разомкнута. Реакции окисления и восстановления актуальны, когда ток способен передаваться по внешней цепи.
Как сделать батарейку своими руками
Чтобы образовался ток, должны пройти определенные химические реакции. Источники питания всегда имеют пару электродов и электролит. В солевых и щелочных батареях анод сделан из цинка, а катод – из марганца. В аккумуляторах, предусматривающих перезарядку, катод – литиевый, а для анода используют разные материалы. Когда делается батарейка своими руками, электрод бывает из: меди, цинка, алюминия, железа. В качестве электролита выступают доступные средства, начиная солью, уксусом, и заканчивая кислотами, например, лимонной. Конечно, из-за нестабильного напряжения и незначительной емкости результаты экспериментов не тянут на полноценные батарейки, покупаемые в магазине.
Лимон
Чтобы получить электроэнергию из этого фрукта, берут: лимон, кусок чего-то из меди и из стали, и пару проводов, которые послужат изоляцией. В первую очередь выполняют зачистку металлических изделий. Удобно делать это наждачной бумагой.
В качестве стального предмета годятся простые гвозди, которые есть в любом гараже. А медным изделием послужит, к примеру, десяти- или пятидесятикопеечная монетка.
В лимон втыкают гвоздь и монету, а между ними оставляют зазор около 3 см. Это будут электроды, к которым присоединяют провода, или просто вставляют рядом. Монета выполняет роль «плюса», т.е. положительного контакта, гвоздь – «минуса».
Вместо лимона подойдет и яблоко, желательно покислее, что нужно для эффективного протекания химической реакции.
Источник питания из фрукта характерен напряжением в 0.5 – 0.7 В. Этого значения мало, телефон точно не зарядить. Чтобы поднять напряжение до 3 – 5 В, последовательно соединяют нескольких плодов.
Интересно, но цепь предполагает получение заряда. Для этого в нее включают батарейку типа «крона» или устройство, которым заряжают мобильник.
Медь контактирует со сталью – это и необходимо для вырабатывания электричества. Кислота внутри фруктов служит для запуска реакции. Импровизированный элемент питания будет работать так долго, пока не выйдет вся кислота из лимона или яблока, или пока не отвалятся контакты.
Банка с электролитом
Этот эксперимент схож с тем, как придумали первый гальванический источник питания. Электродные стальные: катод – из меди, анод – алюминия. Вместо проводов берут пластины, желательно с площадью побольше, и помещают в емкость – стакан или банку из стекла.
Далее берут проводники и припаивают к электродам. Обычно используют болт или заклепку, так как с алюминием работать непросто. Пластины размещают таким образом, чтобы их плоскости были направлены друг на друга. Касаться они не должны. Для фиксации положения пластины крепят к крышке или используют диэлектрические распорки.
Рабочей средой, то есть электролитом, служит нашатырь. Это вещество в виде белого порошка, продающееся в магазине со средствами для пайки. Это же вещество есть в хлористом аммонии (минеральное удобрение). Чтобы приготовить токопроводящую среду, в 100 мл воды растворяют 50 г нашатыря.
Другой вариант раствора – из серной кислоты. Пропорции – 20 к 100. Во время работы придерживаются техники безопасности, надевают перчатки и очки. Сначала высыпают кислоту, потом заливают ее водой. Если сделать наоборот – произойдет реакция, и жидкость «вылетит» из емкости.
Раствор льют до краев, проверяя параллельно напряжение при помощи тестера. Если значения недостаточно, делают последовательное соединение.
Медные монеты
Электролитом служит столовый уксус, а электродами – алюминиевая фольга и монетки из меди. Дополнительное сырье – плотный картон, проводники.

- Ориентируясь на диаметр монет, вырезают кругляшки из картона и фольги.
- Пропитывают картонные заготовки в укусе.
- Также в укус опускают монетки, чтобы снять оксидную пленку с поверхности.
Далее выполняется сборка элемента питания, пирогом: монетка, картон, фольга. Размер «пирамиды» зависит от количества подготовленных материалов. Первым и последним элементом должна быть монета, и к ним предварительно припаивают проводники. В завершение вокруг изделия наматывают скотч.
Пивная банка
«Минусом» будет корпус банки из-под пива или энергетика, сделанный из алюминия. «Плюсом» – графитовый стержень.
Дополнительное сырье: вода, соль, парафиновые свечи, пенопласт и угольная пыль. Сначала срезают верхушку банки. Затем из пластика вырезают кругляш, оставляют в нем отверстие для стержня и опускают в емкость. Графитовую палочку располагают посреди банки. Оставшаяся емкость заполняется угольной пылью. Далее заливается водный раствор соли: на пол литра воды сыпят три столовые ложки соли. На края банки капают парафином.
Картошка, соль и зубная паста
Отличный рецепт, который выручит, если, например, в походе нечем разжечь костер. Требующееся сырье: картофель, соль, зубная паста, пара зубочисток, проводники из меди.
Начинают с картошки, которую режут пополам, вдоль. Из одной части вырезается сердцевина, куда высыпают соль и добавляют пасту. Это будущий электролит. Его тщательно перемешивают, и добавляют столько, пока не дойдет до краев.
Во второй части картофеля делают сквозное отверстие, чтобы получилось две дырки. В них вставляют провода с заранее удаленной изоляцией. Снизу овоща они должны выступать примерно на 1 см. Две части складывают таким образом, чтобы проводники попали в рабочую среду. В качестве соединительного элемента используют зубочистки.
Описанные способы хороши для наглядной демонстрации работы гальванических элементов. Экспериментальные батарейки не заменят настоящие, сделанные с учетом всех тонкостей, но получать новые знания и отрабатывать их на практике ведь никто не запрещает.
Источник
Как сделать аккумулятор своими руками
Есть множество способов сделать самодельные батарейки. К сожалению, большинство самодельных аккумуляторов либо бесполезны, либо потенциально опасны и сложны в изготовлении. Батареи из лимона и картофеля, как правило, очень слабые и требуют в качестве материала скоропортящегося органического растительного материала, в конструкцию свинцово-кислотных аккумуляторов входят высокотоксичные и едкие химикаты и т.д.
Эта батарея сделана из очень простых и доступных материалов, и обладает достаточной мощностью для работы устройств. Когда традиционные батареи недоступны эта батарея будет отличным аварийным источником электроэнергии. Кроме того, ее можно легко перезарядить практически от любого источника постоянного тока, она очень легкая и, в отличие от более распространенных алюминиево-воздушных батарей, не требует воздушного потока для работы.
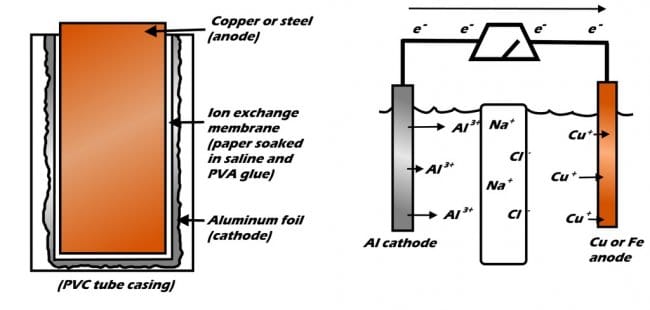
Шаг первый: дизайн и теория
Принцип работы батарей основан на химической реакции, известной как окислительно-восстановительная реакция. В окислительно-восстановительной реакции одно вещество окисляется (теряет электрон), а другое восстанавливается (приобретает электрон). Довольно просто. Любая батарейка устроена схожим образом, в ней обязательны три элемента, между которыми происходит химическая реакция, в результате которой возникает электричество: электроды — анод, катод, и электролит.
В этой алюминиево-металлической батарее две половины батареи пропитаны физиологическим раствором и разделены специальной мембраной, пропускающей только ионы натрия и хлора. Алюминий с одной стороны начинает окисляться, в то же время как медь или сталь на противоположной стороне пытаются остаться стабильными.
В принципе любая батарейка или аккумулятор это две металлические пластины, помещенные в специальное химическое вещество – электролит. Одна пластина подключается к плюсу, вторая к минусу. Пока батарею не трогают, на ней остается стабильное напряжение, например, 3 или 9 В. Стоит подключить к батарейке нагрузку, лампочку, вентилятор, как от плюса к минусу потечет ток. Напряжение начнет падать и сразу же начнется окислительно-восстановительная реакция. Электроны начнут перетекать с отрицательной (-) пластины обратно на положительную, поддерживая тем самым разность потенциалов между ними.
Реакции бывают обратимыми (аккумулятор) и необратимыми (батарейка). Т.е. в батарейке реакция необратимая и ее нельзя зарядить, а в аккумуляторе обратимая и он заряжается. Если подключить аккумулятор к зарядному устройству, ток внутри него начинает течь в обратном направлении, то есть – от «+» к «-». И реакция в электролите также начинает идти в обратном направлении. В результате, продукт реакции разлагается на исходные вещества. Аккумулятор «заряжается»
Конечно, этот процесс не бесконечен и наступит момент, когда одна из пластин разрушится и химическая реакция больше не сможет проходить.

Шаг пятый: зарядка и проверка
Аккумуляторная батарея готова, но ее нужно зарядить. Можно использовать практически любой источник постоянного тока, если ток не слишком велик (до 5 А). Чтобы зарядить аккумулятор, нужно подключите анод к плюсу зарядного устройства, а катод к минусу. Во время зарядки ток начнет уменьшатся по мере того, как батарея набирает заряд. Это является хорошим признаком, и говорит о том, что батарея работает правильно. После зарядки нужно проверить аккумулятор мультиметром. Используя медный анод, мастер получил максимальное напряжение 1,44 В после скромного цикла зарядки. Максимальный ток, который он получил от батареи, был большим для такой самодельной батареи — 1.2 А. Для сравнения, лимонные или картофельные батареи обычно выдают в лучшем случае всего несколько миллиампер. Коммерческая батарея D-cell может выдавать ток более 5А.
Так же мастер провел тест, в котором сравнил свою батарею с настоящим D-элементом на 1,5 В. Обе батареи тестировались с небольшим двигателем постоянного тока. При этом измерялся ток и скорость вращения двигателя. И самодельная и промышленная батареи показали примерно одинаковые результаты.
Конечно, этот аккумулятор не идеален. Ионообменная мембрана по-прежнему пропускает некоторые растворимые соли меди на катодную сторону батареи, где они вступают в реакцию с образованием металлической меди и нерастворимых оксидов и гидроксидов меди. Кроме того, алюминиевый катод постепенно приходит в негодность, по сути, растворяется. Но, несмотря на это, батарея очень удобна и может быть легко собрана и использована людьми в экстремальной ситуации. Увеличивая размер батареи, и подключая несколько ячеек последовательно или параллельно, можно производить или хранить очень большое количество энергии с небольшими затратами.
Источник
Как сделать аккумулятор
Всегда можно получить постоянное напряжение для питания небольших электронных устройств, если знать, как сделать аккумулятор своими руками. Аккумуляторы отличаются от батареек обратимостью своих химических реакций. Это значит, что они не только вырабатывают электрический ток и со временем разряжаются, а также обладают способностью восстанавливаться. Для этого нужно выполнить заряд, пропуская через аккумулятор ток от внешнего источника.
Как сделать аккумулятор своими руками
Химический источник тока (двухполюсник), способный после разряда восстанавливаться, можно выполнить своими руками. Любой химический источник тока, имеющий периодический режим работы (разряд – заряд), состоит из следующих основных элементов:
- электроды: анод и катод;
- электролит;
- разделительные пластины (сепараторы);
- корпус;
- контактные клеммы (выводы).
В качестве анода и катода используются различные пары химических элементов. Анод имеет отрицательный заряд – восстановитель, катод положительный заряд – окислитель.
Оба электрода погружены в электролит. Это водные растворы солей и кислот, проводящие электричество. Когда происходит разряд аккумулятора (двухполюсника) на нагрузку, анод окисляется и вырабатывает электроны, которые через электролит движутся к катоду. На катоде происходит процесс восстановления окислителя.
Важно! При работе на нагрузку ток через двухполюсник течёт от минуса к плюсу, при зарядке от постороннего источника тока (ИТ) – от плюса к минусу.
Для создания одной банки простейшего аккумулятора из меди и цинка понадобятся следующие детали:
- медная проволока длиной 100 мм;
- оцинкованная пластина размерами 25 * 50 мм;
- прокладка – вырезанная из москитной полиэтиленовой сетки полоска;
- электролит – соляной раствор;
- корпус из непрозрачного материала – герметичный стаканчик из-под кофе с крышкой.
Необходимо, чтобы ёмкость для аккумулятора была непрозрачной.
Сборка элемента производится в следующей последовательности:
- медная проволока скручивается спиралью, для увеличения площади рабочей поверхности к верхнему концу припаивается отвод;
- оцинкованная пластина также скручивается по окружности, к верхней части пластины припаивается отвод;
- в крышке баночки делается два отверстия для выводов: в центре – для медной проволоки и ближе к краю – для вывода цинкового электрода;
- медную спираль располагают по центру, вокруг неё размещают цинковую трубку, между ними вставляют изолирующую прокладку;
- заливают электролит: солёную воду (1л воды на 5 ст. л. соли) или уксус 15%;
- неплотно прикрывают крышку, предварительно продев в неё выводы.
К полученной банке подключают источник тока для зарядки самодельного аккумулятора. При этом нельзя плотно закрывать крышку. Или для выхода газов при заряде в ней проделывается множество мелких отверстий (кроме отверстий для выводов). У самодельного элемента плюс – на медном электроде, минус – на цинковом.
Внимание! Чем меньше расстояние между элементами меди и цинка, и чем больше площадь поверхности электродов, тем большее напряжение выдаст подобная аккумуляторная ячейка.
В идеале такой элемент вырабатывает 0,7 вольта. Недостаток такой АКБ заключается в высоком внутреннем сопротивлении и быстром саморазряде.
Как сделать мощный аккумулятор своими руками
Для того чтобы самодельный аккумулятор выдавал на выходе более 3,6 В постоянного тока, нужно собирать самодельные банки в последовательно соединённую батарею. Можно единичные элементы помещать в общий корпус.
Качественные системы зарядки Li-ion 18650
Литий-ионные источники электричества этого типа широко эксплуатируются с различными устройствами. Для их продолжительной работы необходима постоянная подзарядка. При заряде напряжение на элементе достигает значения 4,2 В, после чего снижается до 2-3 В. При глубоких разрядах (ниже 3 В) срок службы Li-ion 18650 значительно сокращается.
Важно! На долговечность влияет количество циклов «заряд-разряд». Это оптимальное число циклов, при которых ёмкость батареи при первом заряде (номинальная), отличается от текущей ёмкости после заряда не более, чем на 20%. Нормальным считается показатель – 350-500 циклов «заряд-разряд».
Существуют специальные зарядные устройства для подобных аккумуляторов, но их можно сделать самостоятельно, используя схему.
Регулировка тока осуществляется подбором резистора R4 на первоначальное значение тока зарядки. Он зависит от емкости аккумулятора. Например, если ёмкость батареи 3000 мА/ч, то ток зарядки равен 2-3 А.
Заводские системы контроля заряда самостоятельно делают регулировку этого параметра в рамках всего времени заряда.
Самодельная батарейка из подручных средств
Как можно сделать аккумуляторы, используя электролит и электроды, рассмотрено выше. Теперь о том, как быстро собрать источник тока однократного действия. Батарейка – это гальванический источник электричества, который не имеет способности восстанавливаться.
Способ первый: батарейка из лимона
Мякоть лимона содержит лимонную кислоту, она послужит электролитом. В качестве электрода выступают оцинкованный гвоздик и отрезок медной проволоки. Они втыкаются в лимон на расстоянии 50-100 мм друг от друга. Реакция окисления запускает движение электрического тока.
Способ второй: банка с электролитом
Литровую стеклянную банку используют в качестве ёмкости. В качестве электродов берутся цинковая и медная пластины. К пластинам прикрепляются провода, сами они опускаются в банку с электролитом. Им служит 20% раствор серной кислоты. Также можно использовать хлористый аммоний (нашатырь). На 100 мл воды берут 50 г. порошка. Уровень электролита не достигает края банки на 15-20 мм.
Осторожно! Работа с серной кислотой при приготовлении электролита подразумевает добавление воды в кислоту, а не наоборот. При приготовлении раствора необходимо использовать стеклянную посуду и стеклянную или деревянную палочку для перемешивания.
Способ третий: медные монеты
Принцип использования медного катода и алюминиевого анода рассмотрен в этом способе. Процесс изготовления источника тока следующий:
- по форме медных монет одного размера (медный пятак) вырезают кружочки из алюминиевой фольги и плотного картона (обложка старой книги);
- монеты очищаются путём погружения в уксус, им же пропитываются и кружочки картона;
- картон вставляется между монетой и кружком фольги, которые служат катодом и анодом.
Собранная таким образом батарея будет работать до тех пор, пока не высохнет электролит, пропитавший картонные кружки.
Способ четвертый: батарейка в пивной банке
Сам корпус пивной банки (алюминиевый) служит анодом (минус), в качестве катода используют графит. При изготовлении выполняются следующие шаги:
- удаляется верхняя часть банки;
- пенопластовый кружок диаметром, равным внутреннему диаметру банки, и толщиной не менее 10 мм укладывается на дно банки;
- в его центр вставляется графитовый стержень подходящего диаметра;
- свободное пространство между ним и стенками банки заполняется угольной крошкой;
- соляным раствором (5 ст. л. соли на 0,5 л воды) заполняется полученный элемент;
- верхняя часть устройства заливается расплавленным парафином или стеарином (от свечи);
- к стержню и корпусу банки с помощью зажимов «крокодил» присоединяются провода.
Способ пятый: батарейка из картошки
Это вариант использования химической реакции окисления между медными и оцинкованными полосками, в качестве электролита используется мякоть картофеля.
Внимание! Полученные напряжения таких источников настолько малы, что подобные конструкции могут служить лишь в качестве опытов для изучения происхождения электричества.
Способ шестой: графитовый стержень
Графитовый сердечник обматывается пористой фибровой салфеткой. Поверх него наматывается по спирали алюминиевая проволока. Вся конструкция опускается в подходящий по размеру стакан, заполненный «Белизной». Водный раствор хлорки служит электролитом.
Несмотря на всё разнообразие способов и видов самодельных источников тока, все они работают, благодаря электролитическим процессам и химическим реакциям окисления. Правильно подобранные пары элементов для анода и катода, а также использование подходящего электролитического раствора дают реальные результаты. Можно сделать аккумулятор своими руками для питания гаджетов и малогабаритных устройств.
Видео
Источник