Настольный набор для редактирования генов
Биолог Джосайя Зайнер предлагает новый подход к популяризации самой передовой части биологической науки
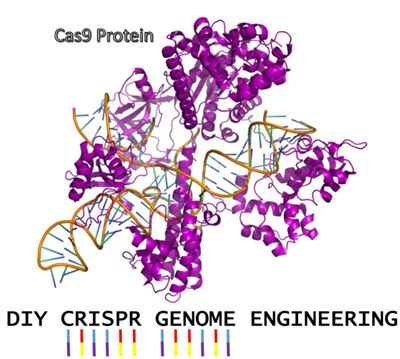
Инструмент CRISPR для редактирования генома был изобретен три года назад и является простым, быстрым и точным способом вмешательства в ДНК. Однако до сих пор CRISPR применяли лишь квалифицированные специалисты в специализированных лабораториях.
Методика CRISPR позволяет редактировать геном даже на кухне
Джосайя Зайнер первым решился выпустить на рынок упрощенный и доступный для непрофессионалов набор инструментов CRISPR для вмешательства в геном. Это провокационная инициатива, ведь сегодня образ жизни и мышления общества во многом формирует терроризм. В результате генные модификации бактерий в домашних условиях ассоциируются в большинстве случаев с разработкой смертельных штаммов для биотеррористов.
Также ученые опасаются, что непрофессионалы могут случайно создать суперштаммы микроорганизмов, устойчивые к антибиотикам. Даже если такие бактерии и грибки окажутся безопасными для человека, они могут вызвать непредсказуемые изменения в окружающей среде.
Генные модификации в наборе безопасны и позволяют лишь незначительно менять внешние параметры микроорганизмов, например их цвет
Однако, по словам Зайнера, в его наборе лишь безопасные бактерии и дрожжи, которые не могут выжить в суровой внешней среде и живут недолго. Генная модификация с помощью инструментов набора позволяет лишь незначительно менять их свойства, например цвет или запах.
Набор для домашних экспериментов в генной инженерии стоит $120
Джосайя Зайнер считает, что благодаря его набору множество талантливых любознательных людей могут оказать огромную помощь биологии. Интерес к генной инженерии имеет огромную ценность для науки, поэтому дешевый набор Зайнера может сыграть в истории биологии даже большую роль, чем несколько дорогостоящих суперсовременных лабораторий.
Надо отметить, что краудфандинг принес проекту Зайнера более $55 тыс. — на 333% больше, чем планировал разработчик набора для домашнего редактирования генов.
Источник
Генная инженерия от A до Z часть 2
Итак, настало время продолжения статьи о том, как все же сделать светящуюся елку к следующему новому году с применением настоящей генной инженерии, а не той, о которой вы до этого могли прочитать в новостях 🙂
Ученые открыли ген синего свечения. Мы прочитали об этом гене и загорелись сделать светящуюся трансгенную елку. Нашли в специализированных ресурсах его название и последовательность, выбили командировку у шефа и скатались туда, где живет животное – бутявка, в которой содержится этот ген.
Путем различных ухищрений с применением специального оборудования мы получили чистые молекулы ДНК гена bl1, кодирующего белок синего свечения.
У нас есть ген. Чего же мы ждем, спросят читатели, давайте засунем этот ген в елку и она начнет светиться?
Не все так просто, и вот, почему.
Любой ген работает только когда с него считывается информация. В нашем случае это мРНК белка bl1. Более того, сама мРНК должна работать, но это отдельная история.
Второе – ген должен передаваться при делении клетки ее потомкам. Иначе все пойдет насмарку.
Третье – ведь ген это не булавка, его еще засунуть как-то нужно!
Если мы просто поместим в клетку ген, то ни информация с него не будет прочитана, ни передаваться он не будет (да, собственно, и с засовыванием его большие проблемы). Поэтому, мы должны навесить на него какую-нибудь служебную информацию, которая бы позволила ему работать и облечь в форму, которая позволит передаваться потомкам. А так же каким-то образом занести его в клетку.
Однако еще раньше мы постараемся сохранить имеющийся ген, чтобы в любой момент можно было его получить много и не ездить за бутявкой.
Самая первая задача, которая стоит на каждом этапе – сохранить результаты предыдущих этапов. Актуальная задачи и в программировании, не правда ли? 🙂
Сейчас мы поместим наш ген в бактерию, так, чтобы в любой момент мы могли ее размножить и достать оттуда необходимое количество. Это будет наш первый трансгенный организм и процесс его создания называется трансформацией.
Почему мы просто не можем размножить ген с помощью ПЦР, как мы делали до этого? Дело в том, что вероятность ошибки в реакции ПЦР 1/10^3, а в бактерии 1/10^6, то есть копирование его происходит в тысячу раз точнее, а точность нам нужна абсолютная и чем больше, тем лучше.
Итак, помещаем ген в бактерию, как же это сделать? Для этого для начала подготовим контейнер — специальную кольцевую молекулу ДНК, называемую плазмидой. Эта плазмида может плавать в клетке бактерии независимо от ее генома, размножаться и передаваться потомкам, так как у нее есть необходимые для этого гены и сигнальные последовательности.
Так же в плазмиде есть гены маркёры. Это такие гены, которые помогут нам отобрать клетки с плазмидой, от клеток где ее нет. Маркёром, например, может быть ген окраски (бактерии с плазмидой будут окрашены) или устойчивости (бактерии с плазмидой не умрут на среде с антибиотиком).
Плазмиды можно купить в биотехнологической компании, их продают всем желающим. Прийдет она к вам в виде прозрачного раствора в небольшой пробирке (собственно, так же выглядит раствор любой другой ДНК). Для вставки гена в плазмиду ее нужно надрезать ферментом — рестриктазой (речь о ней пойдет далее), но часто они продаются уже надрезанными.
Допустим мы купили современную плазмиду, например pJET1,2 от Fermentas.
Вот она, красавица. В верхнем правом углу много мелких названий – это перечислены сайты рестрикции. Rep – это участок отвечающий за репликацию (размножение) плазмиды в клетке, а Amp – репортерный ген устойчивости к антибиотику – ампициллину.
К плазмиде поставляется набор реактивов, так называемый “кит”. Мы капаем по инструкции чуть чуть раствора нашего гена, плазмиды с реактивами из кита и фермента лигазы и получаем раствор, где молекулы плазмиды соединились с молекулами гена и получилась единая кольцевая молекула, содержащая ген bl1.
Такую плазмиду называют “плазмида со вставкой”.
Фермент лигаза сшивает пристыкованые друг к другу участки ДНК. Она сшивает все подряд и не может определить, правильно ли все пристыковано (например, может просто сшить плазмиду саму с собой, вовсе без нашего гена), поэтому наша задача делать так, чтобы стыковаться молекулы могли только определенным образом. Чуть дальше я расскажу об этом, когда пойдет речь о липких концах.
Плазмида pJet1,2 продается уже разрезанной посередине гена eco471R. Это ген кодирует клеточный яд – мощную рестриктазу, которая убъет клетку если лигаза сошьет плазмиду без вставленного гена bl1 и такая плазмида попадет в бактерию. Это очень удобно, так как нам не нужно беспокоиться, что вырастут бактерии, в которых вовсе нет вставки, что бывает с другими типами плазмид (этот тип назван плазмидой-самоубийцей или “selfkill plasmid”).
Изначально эта информация выходила за рамки статьи, но я подумал, что иначе будут вопросы, зачем этот ген 🙂
Далее берем специально подготовленную культуру бактерий кишечной палочки (Echerichia coli или E.coli) и по протоколу трансформации капаем в них раствор плазмиды со вставкой. Протоколы могут быть разные, вот пример. Бактерии очень легко поддаются трансформации, по сути ДНК просто в них проникает и все, никаких других ухищрений.
Обычно трансформацию делают вечером, наутро бактерии подрастают и мы уже имеем результаты.
На чашке Петри со средой для роста, имеется множество колоний. Каждая колония — потомки одной единственной трансформированной клетки. Мы выбираем некоторые из них, тестируем на содержание bl1 методом ПЦР (чтобы убедиться в наличии гена) и можем положить на хранение.
Бактерии растут очень быстро и теперь плазмиду с геном можно выделить из них в любой момент в нужном количестве
Итак, мы засейвились 🙂 и параллельно получили культуру трансгенных бактерий. Будут они светиться или нет зависит от того, какую плазмиду для трансформации мы выбрали, есть ли в ней сигнальная последовательность для синтеза мРНК – промотор.
Отмечу, что вот такое сохранение промежуточных результатов всегда проводят в бактериях, независимо от того, с каким далее объектом происходит работа. Просто с ними очень удобно работать и хранить (быстро заморозив в жидком азоте).
Подготовка транскрибирующейся последовательности.
Чтобы последовательность гена работала в клетке, с нее должна прочитываться мРНК(а с нее — белок), то есть она должна транскрибироваться. Для того чтобы это произошло, перед геном обязательно должна стоять управляющая последовательность – промотор.
Промоторы есть у всех генов и они отвечают за то, в каких условиях должен синтезироваться ген, однако определенные промоторы работают только в определенных организмах. Так, бактериальные промоторы не работают у растений и наоборот, растительные – в бактериях. Так как мы хотим, чтобы елка светилась ярко, то поставим ген под суперпромотор, который работает постоянно. Для растений им может являться промотор 35S из вируса мозаики цветной капусты.
К счастью на не нужно искать этот вирус и цветную капусту 🙂 Можно купить уже готовую плазмиду, содержащую промотор и имеющую место для вставки гена. Например, такую как на рисунке.
Следующий шаг — мы выделяем плазмиду со вставкой из культуры бактерий и вырезаем оттуда ген. Вырезание производится с помощью ферментов-рестриктаз (просто к раствору плазмидной ДНК добавляем фермент и буфер для работы фермента). По бокам от встроенного нами гена в плазмиде содержатся участки ДНК (сайты рестрикции), которые ими узнаются и происходит разрезание.
Всегда нужно выбирать те рестриктазы, которые будут резать только в одном месте, не разрезая сам ген (определенная рестриктаза всегда узнает определенный сайт, который состоит обычно из 6 определенных нуклеотидов). Например, рестриктаза EcoR1 всегда разрежет ДНК если обнаружит в ней последовательность G’AATTC, причем резать будет и одну цепь и вторую.
Если рестриктаза режет не точно посередине последовательности узнавания, то по краям остаются так называемые “липкие концы”, где часть ДНК одноцепочечна. Такие концы имеют свойство “липнуть”- пристыковываться к другим липким концам с той же последовательностью одноцепочечных участков. Если последовательность будет иной, то стыковки не произойдет. Таким образом если мы вырежем ген двумя рестриктазами – одной для начала гена и другой для конца, то начало и конец его будут иметь разные концы, которые соединятся только с себе подобными. Это очень важно для контролирования ориентации гена, ведь работает он только если повернут определенным образом к служебным последовательностям.
Некоторые рестриктазы могут порезать четко посередине и получим “тупые концы”. По тупым концам тоже можно сделать сшивку, но получится 50% вероятность пришить ген не той стороной которой нужно, а задом наперед.
После вырезания гена очищаем его от остатков плазмиды с помощью электрофореза.
Аналогичным образом разрезаем купленную плазмиду с промотором и смешиваем ее с вырезанным геном.
Добавляем лигазы и вуаля – имеем сшитую последовательность, где у нас имеется промотор 35S и ген bl1.
Снова трансформируем бактерии, уже этой полученной конструкцией. Так как мы ввели промотор, работающий у растений, то светиться такие бактерии не будут. Если бы мы ввели бактериальный промотор, то на этом шаге культура бактерий бы засветилась.
Плазмида с промотором, геном, маркёрами и другими служебными частями называется “плазмидой для экспрессии”. Ее уже можно использовать для получения трансгенных растений.
Это у нас второе сохранение. Мы уже знаем как заставить бактерии светиться и получили почти все необходимое, чтобы получить трансгенные растения.
Заметьте, процесс генноинженерной работы многоступенчатый и многозадачный. В реальной жизни одновременно происходит работа с 3-4 экспериментами находящимися на разных стадиях. Пока в одном растут бактерии, для другого мы проводим рестрикцию плазмиды, а для третьего выделяем ген. Происходит это из-за того, что никогда не бывает настолько идеально гладкого хода работ, как я описал, всегда возникают проблемы по разным причинам, их приходится обнаруживать, преодолевать. Даже на выявление ошибки на каждой стадии уходит минимум несколько часов.
И именно для преодоления проблем нужен весь объем знаний молекулярного биолога, а не для последовательного капанья из одной пробирки в другую, чем может заниматься и лаборант 🙂
Но о том, как же мы все-таки получим светящуюся синим елку, я расскажу в заключительной статье. Там же приведу список оборудования и реактивов, с ценами 🙂
Источник
Изменение собственных генов всего лишь одной инъекциeй – если, конечно, вы везучи
Биохакер Джошуа Зайнер хочет создать мир, в котором любой человек способен и в праве экспериментировать со своей ДНК.
«У нас здесь немного ДНК и шприц», – говорит Джошуа Зайнер в комнате, полной синтетических биологов и других исследователей. Он наполняет иглу и вонзает её в кожу. «Это изменит мои мышечные гены, и даст мне больше мышечной массы».
Зайнер – биохакер, он экспериментирует с биологией в DIY, а не в обычной лаборатории, – выступил на конференции SynBioBeta в Сан-Франциско с докладом «Пошаговое руководство по генетическому изменению себя с помощью CRISPR», где в других презентациях участвовали академики в костюмах и молодые руководители типичных биотехнологических стартапов. В отличие от прочих, он начал своё выступление, раздавая образцы и буклеты, в которых объяснялись основы DIY генной инженерии.
Биохакер Зайнер выступил на конференции SynBioBeta с докладом «Пошаговое руководство по генетическому изменению себя с помощью CRISPR»
Если вы хотите генетически модифицировать себя, – это не обязательно сложно. Когда он предложил образцы в маленьких пакетиках толпе, Зайнер объяснил, что ему потребовалось около пяти минут, чтобы сделать ДНК, которую он привёз на презентацию. В пробирке был Cas9, фермент, который разрезает ДНК в определённом месте, ориентированном по направляющей РНК, в системе редактирования генов, известной как CRISPR. В этом примере он был разработан для выключения гена миостатина, который вырабатывает гормон, ограничивающий рост мышц и уменьшающий мышечную массу. В исследовании, проведённом в Китае, собаки с отредактированным геном имели удвоенную мышечную массу. Если кто-то из зрителей захотел попробовать, они могли взять пробирку домой и ввести его позже. Даже капая его на кожу, сказал Зейнер, вы получите эффект, хотя и ограниченный.
Зайнер имеет докторскую степень по молекулярной биологии и биофизике, он также работал научным сотрудником в НАСА по модификации организмов для жизни на Марсе. Но он полагает, что синтетическая биология для редактирования других организмов или себя может стать столь же простой в использовании, как, например, CMS для создания веб-сайта.
«Вам не нужно знать, какой промотор использовать чтобы заставить работать нужный ген или фрагмент ДНК, – говорит он, используя некоторые технические термины из генной инженерии. «Вы не хотите знать, какой терминатор использовать, или ориджин репликации… Инженер, программирующий ДНК, должен знать, как это сделать. Но единственное, что вам нужно знать, – так, я хочу, чтобы гриб был фиолетовым. Это не должно быть сложнее. Всё это вполне возможно – это просто создание инфраструктуры и платформы, чтобы любой мог это сделать».
Конечно, магазин приложений для генетического редактирования ещё не создан. Но немалое число биохакеров узнали достаточно, чтобы – порой необдуманно – экспериментировать над собой. Несколько человек, которых Зайнер знает, например, начали вводить себе миостатин. «Это происходит прямо сейчас», – говорит он. «Все эти вещи начали появляться буквально в последние несколько недель». Пока ещё рано говорить о том, улучшили ли инъекции экспериментаторов или вызвали проблемы, но некоторые надеются увидеть результаты в ближайшие месяцы.
Несмотря на проведённое в академических кругах время, Зайнер явно не является типичным исследователем и избегает идеи, что эксперименты должны ограничиваться лабораториями. Когда в НАСА он начал общаться с другими биохакерами через список рассылки, и узнал о проблемах тех, кто хотел делать DIY работу, – поставщиков было трудно найти, и они не всегда отправляли нужные заказы тем, у кого не было лаборатории, – он в 2013 году начал бизнес под названием The ODIN (Open Discovery Institute, and an homage to the Norse god), чтобы пересылать комплекты и инструменты людям, желающим работать в своём гараже или комнате. В 2015 году, решив покинуть НАСА, потому что ему не нравилось работать в их консервативной среде, он запустил успешную кампанию по сбору средств для набора DIY CRISPR.
«Единственное, что вам нужно знать, – так, я хочу, чтобы гриб был фиолетовым. Это не должно быть сложнее.»
В 2016 году он продал продуктов на сумму $200 000, включая набор для дрожжей, которые можно использовать для заправки светящегося биолюминесцентного пива, набор для обнаружения антибиотиков дома и полную домашнюю лабораторию по цене MacBook Pro. В 2017 году он ожидает удвоения продаж. Многие наборы просты, и большинство покупателей, вероятно, не используют их, чтобы изменить себя (многие комплекты идут в школы). Но Зайнер также надеется, что по мере получения новых знаний, люди будут экспериментировать более необычными способами.
Зайнер продает полную домашнюю лабораторию биохакинга примерно по цене MacBook Pro.
Он задаёт вопрос, являются ли традиционные методы исследования, такие как рандомизированные контролируемые испытания, единственным способом сделать открытия, указывая на то, что в новой персонализированной медицине (такой как иммунотерапия рака, которая персонализирована для каждого пациента), размер выборки одного человека имеет смысл. В своём выступлении он утверждал, что люди должны иметь возможность самостоятельно экспериментировать, если захотят; мы меняем нашу ДНК, когда пьём алкоголь или курим сигареты, или дышим грязным городским воздухом. Многие действия, санкционированные обществом, более опасны. «Мы жертвуем, возможно, миллион людей в год автомобильным богам» – сказал он. «Если вы спросите кого-нибудь: ‘Не могли бы вы избавиться от автомобилей?’ – нет.» (Зайнер экспериментировал по-разному, включая экстремальную пересадку фекалий DIY, которая, по его словам, вылечила его проблемы с пищеварением, он также помогает больным раком с DIY иммунотерапией).
Если вы измените свою ДНК, вы можете затем секвенировать свой геном, чтобы увидеть, произошло ли изменение. Но эксперимент в гараже не может предоставить столько информации, сколько обычные методы. «Вы можете подтвердить, что вы изменили ДНК, но это не значит, что оно безопасно и эффективно», – говорит Джордж Чёрч, профессор генетики в Гарвардской Медицинской Школе (которая также выступает в качестве адвайзера компании Зайнера, признавая ценность биологически грамотной публики в веке биологии). «Всё, что он делает, – говорит вам, что вы сделали правильную работу, но это может быть опасно, потому что вы также изменили что-то ещё. Это может быть неэффективным в том смысле, что недостаточно клеток было изменено, или уже слишком поздно, и ущерб уже был нанесён». Если ребёнок рождается с микроцефалией, например, изменение генов в его теле, скорее всего, не повлияет на его мозг.

«Мы живём в невероятное время, когда мы изучаем очень многое в биологии и генетики благодаря CRISPR, но мы всё ещё многого не знаем о безопасности редактирования человеческих клеток с помощью CRISPR.»
Любой, кто хочет ввести себе модифицированную ДНК, рискует без достаточного количества данных или, возможно, любых реальных данных – о том, что может произойти, для принятия обоснованного решения. Это, наверное, само собой разумеется: не пытайтесь делать это дома. «Мы живём в невероятное время, когда мы изучаем очень многое в биологии и генетики благодаря CRISPR, но мы всё ещё многого не знаем о безопасности редактирования человеческих клеток с помощью CRISPR», – говорит Алекс Марсон, исследователь в области микробиологии и иммунологии в Калифорнийском университете в Сан-Франциско и эксперт по CRISPR. «Очень важно, чтобы оно проходило через тщательные и проверенные тесты безопасности в каждом случае, и делалось ответственным образом».
В Германии биохакинг теперь вне закона, и человек, проводящий эксперименты за пределами лицензированной лаборатории, может получить штраф в размере €50 000 или три года в тюрьме. Всемирное антидопинговое агентство теперь запрещает все формы редактирования генов у спортсменов. Однако в США биохакинг ещё не регулируется. И Зайнер не считает, что вообще должен, он сравнивает опасения, что люди изучают, как использовать синтетическую биологию, с опасениями изучения, как использовать компьютеры, в начале 1980-х. (Он приводит интервью 1981 года, в котором Тед Коппел спросил Стива Джобса, есть ли опасность того, что люди окажутся под контролем компьютеров.) Зайнер надеется продолжать помогать как можно большему числу людей, становится более «грамотными в ДНК».
«Я хочу жить в мире, где люди генетически модифицируют себя. Я хочу жить в мире, где все эти классные вещи, которые мы видим в научно-фантастических телешоу, реальны. Может быть, я сумасшедший и глупый… но я думаю, наверное, это действительно возможно».
Вот почему, он сделал себе инъекцию перед толпой на конференции. «Я хочу, чтобы люди перестали спорить о том, можно ли использовать CRISPR или нельзя, нормально ли генетически модифицировать себя», – говорит он. «Уже слишком поздно: я сделал выбор за вас. Споры закончены. Давайте продолжим. Давайте использовать генную инженерию, чтобы помочь людям. Или дать им фиолетовую кожу».
Источник